Fondo
La barrera hematoencefálica (BBB) es una barrera física y funcional compleja que protege al sistema nervioso central de agresiones físicas y químicas. No obstante, también constituye una barrera frente a las terapias para el tratamiento de trastornos neurológicos. En este contexto, la terapia basada en nanomateriales ofrece una alternativa potencial para superar este problema. La familia del grafeno ha atraído un interés significativo en la nanomedicina porque sus propiedades fisicoquímicas únicas los hacen aptos para aplicaciones en la administración de fármacos / genes y la interfaz neuronal.
Resultados
En este estudio, se encontró óxido de grafeno reducido (rGO) inyectado sistémicamente ubicado principalmente en el tálamo y el hipocampo de ratas. La entrada de rGO implicó una disminución transitoria de la tensión paracelular de BBB, como se demostró a niveles anatómicos (infusión de tinte azul de Evans), subcelulares (microscopía electrónica de transmisión) y moleculares (expresión de proteínas de unión). Además, examinamos la utilidad de la desorción / ionización láser asistida por matriz (MALDI) de imágenes de espectrometría de masas (MSI) como un nuevo método de imágenes para detectar la distribución temporal de nanomateriales en todo el cerebro.
Conclusiones
rGO pudo ser detectado y monitoreado en el cerebro a lo largo del tiempo proporcionado por una nueva aplicación para MALDI-MSI y podría ser una herramienta útil para tratar una variedad de trastornos cerebrales que normalmente no responden al tratamiento convencional debido a la impermeabilidad de la BBB.
Fondo
La barrera hematoencefálica (BBB) tiene una intrincada estructura física y molecular que proporciona un microambiente adecuado para la actividad de las células neuronales. La estructura física consta de un endotelio continuo sin fenestraciones y una membrana basal circundante cubierta por una vaina de patas terminales distales de procesos de astrocitos y pericitos. La estructura molecular consta de una colección de receptores de membrana y portadores altamente selectivos que regulan el movimiento transendotelial bidireccional de moléculas a través de la interfaz sangre-cerebro. El tráfico inter-endotelial de moléculas se evita mediante un contacto de unión elaborado y aplicado de cerca que es proporcionado por proteínas transmembrana de unión y adhesión estrechas, algunas de las cuales están ancladas al citoesqueleto celular.1 ]. La BBB es una estructura altamente dinámica que responde a cambios mínimos en el microambiente sanguíneo y cerebral circulante a través de mecanismos de autoajuste que sirven para proteger la actividad neuronal. Sin embargo, la complejidad de la disposición física y molecular de la BHE impide la accesibilidad de muchos fármacos al sistema nervioso central. Como consecuencia, varios trastornos neurológicos siguen siendo intratables y esto puede ser una causa importante de muerte precoz.
El campo interdisciplinario emergente de la nanotecnología podría proporcionar un medio para superar la naturaleza restrictiva de la BHE con respecto a la entrada de fármacos en el cerebro. Se ha realizado un esfuerzo considerable en la búsqueda de materiales de dimensiones nanométricas susceptibles de cruzar la BHE y administrar fármacos a sitios específicos de lesión [ 2 ]. Entre estos nanomateriales, el grafeno y sus derivados, como el óxido de grafeno reducido (rGO), han atraído un interés significativo; sus electrones π libres y su área de superficie extremadamente alta permiten la interacción con una variedad de biomoléculas, lo que las hace particularmente adecuadas para aplicaciones en ingeniería de tejidos, imágenes moleculares, administración de fármacos / genes [ 3 ] e interfaces neuronales [ 4 , 5 ].
Un aspecto importante en el desarrollo de nanoportadores de fármacos es el de determinar su destino en el cerebro y determinar la cantidad y la forma en que alcanzaron el objetivo. Se han desarrollado varias técnicas in vivo para detectar y medir la captación de nanoportadores de fármacos en el cerebro. Por lo general, la microscopía electrónica de barrido y transmisión (TEM), la microscopía de fluorescencia, la microscopía láser confocal y los estudios de farmacocinética y biodistribución se han utilizado para este fin [ 6 ]. Sin embargo, estas técnicas presentan importantes desafíos técnicos y el seguimiento de la distribución espacial de los nanomateriales a lo largo del tiempo no siempre es fácil o rápido.
En los últimos años, la formación de imágenes por espectrometría de masas (MSI) por desorción / ionización láser asistida por matriz (MALDI) ha surgido como una metodología poderosa para investigar la distribución espacial de biomoléculas específicas en secciones de tejido [ 7 ]. MALDI-MSI se ha utilizado para visualizar átomos y moléculas pequeñas en resoluciones espaciales por debajo de una micra [ 8 , 9 ], que es cercana a la de las nanopartículas con al menos una dimensión ≤100 nm [ 10 ]. El presente estudio se llevó a cabo para probar la hipótesis de que MALDI-MSI podría usarse para detectar y seguir la densidad espacial de rGO en el cerebro. Con fines comparativos, también evaluamos la detección de rGO mediante microcopia láser confocal.
Otro aspecto muy importante a considerar al estudiar el transporte y la entrega de fármacos al cerebro a través de nanomateriales se relaciona con la integridad de la BHE durante todo el tratamiento. Para abordar este asunto, utilizamos tres enfoques para examinar la integridad de la BBB, a saber: (a) observación anatómica general basada en la infusión periférica de tinte azul de Evans, (b) evaluación subcelular por TEM junto con el trazador extracelular de nitrato de lantano para determinar si el marcador escapó al parénquima cerebral, y (c) transferencia de Western (WB) para evaluar el posible desorden célula-célula o célula-matriz en proteínas endoteliales de unión y unión de adhesión y laminina en homogeneizados de tejido cerebral.
Resultados y discusión
Caracterización fisicoquímica de rGO
La absorción de materiales a nanoescala de la circulación y su internalización por el cerebro depende de sus características fisicoquímicas, como morfología, composición, uniformidad, tamaño y carga superficial [ 11 ]. El grafeno está compuesto por una hoja de un solo átomo de espesor de átomos de carbono unidos por enlaces sp2 dispuestos hexagonalmente en una estructura bidimensional que crea una gran superficie a ambos lados del eje plano. Los nanomateriales basados en la familia del grafeno incluyen grafeno de una o pocas capas, grafito ultrafino, óxido de grafeno y rGO [ 12 ].
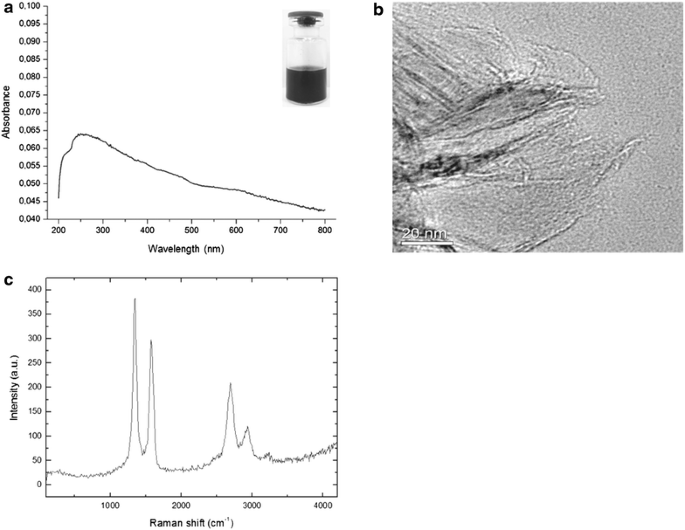
rGO fue el producto de tratar el óxido de grafeno en condiciones reductoras (químicas, térmicas, microondas, fotoquímicas, fototérmicas o microbianas / bacterianas) con el fin de reducir su contenido de oxígeno [ 13 ]. El grado de reducción del rGO diseñado en nuestro laboratorio se investigó mediante espectroscopía UV-Visible. El rGO en agua da como resultado una suspensión negra (recuadro de la Fig. 1 a), que es característica de la forma reducida de óxido de grafeno [ 14 ]. El espectro UV-visible (Fig. 1 a) exhibió un pico de absorción a 265 nm, desplazado al rojo en comparación con el óxido de grafeno, que exhibe una banda de absorción π – π * a 230 nm [ 15]. El efecto de desplazamiento al rojo se puede explicar por una restauración parcial de la red π entre los carbonos en rGO, debido a la eliminación de los enlaces que contienen oxígeno, lo que da como resultado una conjugación electrónica dentro de las hojas reducidas [ 16 ].
Morfología rGO y caracterización fisicoquímica. a Espectro de absorbancia UV-visible de rGO (70 µg / ml, 265 nm). El recuadro muestra la fotografía de suspensión rGO correspondiente. b Imagen HRTEM que muestra parte de la morfología de rGO. c Espectro Raman de rGO con la longitud de onda de excitación establecida en 514,5 nm (láser de iones Ar). El pico C – C sp3 del GO aparece en ~ 1350 cm -1 (banda D) y el pico sp2 en ~ 1598 cm -1 (banda G). au unidades arbitrarias
rGO se mantuvo estable en agua destilada estéril durante más de un mes sin formar aglomerados ni cambiar sus características fisicoquímicas. Esta suspensión acuosa relativamente estable de rGO se puede atribuir a la repulsión electrostática debido a las hojas cargadas negativamente (potencial zeta de -25 ± 0,18 mV) y la presencia de grupos funcionales de oxígeno residual en los sitios de defectos [ 17 ]. Para los experimentos, se caracterizó rGO recién suspendido con respecto al tamaño de partícula, potencial zeta e índice de polidispersidad (PDI) mediante análisis dinámico de dispersión de luz a pH 7,6 y 25 ° C; rGO mostró un diámetro medio de 342 ± 23,5 nm y un PDI de 0,56 ± 0,03. Estos resultados indican que aunque el rGO era de escala nanométrica, estaba polidispersado, como lo indica el valor de PDI.
La morfología de la superficie y los parámetros estructurales de las muestras se determinaron mediante microscopía electrónica de transmisión de alta resolución (HRTEM) y espectroscopía Raman, respectivamente. La espectroscopia Raman es una de las técnicas más poderosas para caracterizar materiales basados en grafeno [ 18 ]. La lámina rGO vista por HRTEM (Fig. 1 b) tenía una superficie relativamente grande y su morfología se parecía a una cortina delgada. El espectro Raman de rGO mostró dos bandas principales, D (1350 cm -1 ) y G (1598 cm -1 ) (Fig. 1 c). Estas firmas de bandas vibratorias son compartidas por todos los átomos de carbono con enlaces sp2 y corresponden a los defectos o bordes (banda D) y a la dispersión Raman de primer orden en el modo E2 g (banda G) [ 19].
Distribución de rGO en el cerebro según lo determinado por MALDI-MSI
MALDI-MSI se ha utilizado anteriormente para localizar fármacos [ 20 , 21 ] y lípidos [ 22 ] en cerebros de roedores. En el presente estudio, se utilizó MALDI-MSI para demostrar la presencia, distribución y densidad de rGO dentro del cerebro a lo largo del tiempo. Para mapear rGO por MALDI-MSI, utilizamos un protocolo establecido para el procesamiento general de muestras que incluía desorción / ionización láser asistida por matriz, análisis de masas y registro de imágenes. Se ha publicado una descripción detallada paso a paso y una discusión de la técnica MALDI-MSI [ 23 , 24 ]. Aunque es común a todas las plataformas MSI, el procedimiento general descrito aquí requiere la optimización de las condiciones experimentales para adaptarse a las muestras biológicas con el fin de obtener los mejores resultados.
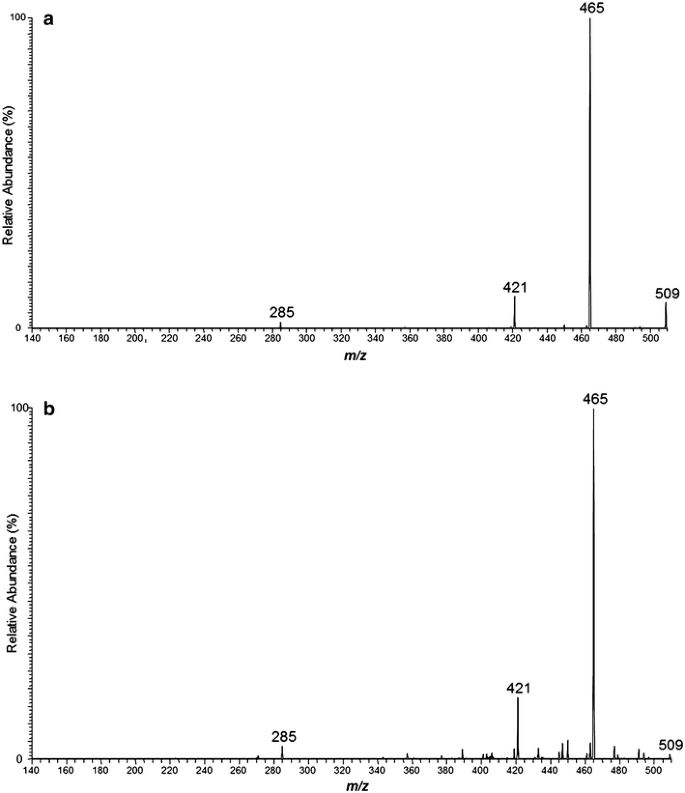
Después de ajustar nuestro modelo experimental con respecto a la preparación de la muestra y la aplicación de la matriz, se confirmó el patrón de fragmentación del rGO. El escaneo láser de las secciones de tejido reveló cuatro picos dominantes en relaciones de masa a carga ( m / z ) de 285, 421, 465 y 509 (Fig. 2 ). El patrón de fragmentación fue el mismo para todas las administraciones de rGO.
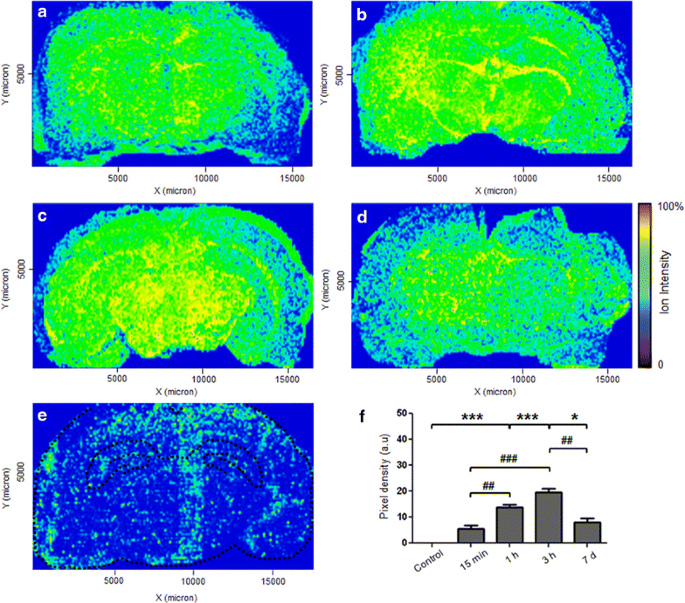
Sobre la base de las relaciones de masa a carga de los iones detectados, se construyeron imágenes compuestas mapeando la distribución de rGO en todo el cerebro de la rata a lo largo del tiempo (datos no mostrados). Los puntos amarillos en la Fig. 3 representan la abundancia de iones con la masa molecular m / z 465 localizados en secciones coronales de cerebro de rata (Fig. 3 a – d).
Imágenes MALDI-MSI de una sección coronal de tejido cerebral de rata y la densidad de rGO en el cerebro. Las ratas recibieron una única dosis (7 mg / kg) de RGO través de la vena de la cola y se sacrificaron a un 15 min, b 1 h, c 3 h y d 7 días después de la administración. e Distribución representativa de la señal m / z 465 en animales de control; la línea punteada negra central delinea los límites del hipocampo. La escala de colores muestra la intensidad de iones del rGO ( color azul para la señal más baja y color amarillo / rojo para la más alta). La evaluación en unidades arbitrarias (au) de intensidad de píxeles (mostrada en f) se normalizó descontando el fondo de la matriz. f Cuantificación de rGO en cerebro en diferentes momentos después de la administración. Las columnas representan la media ± SEM (n = 3 imágenes / intervalo; una imagen por animal). * p <0,05 y *** p <0,001 en comparación con el control correspondiente. ## p <0.01 y ### p <0.001 entre puntos de tiempo tratados con rGO (ANOVA de una vía seguido de la prueba post hoc de Bonferroni)
MALDI-MSI reveló la captación de rGO y demostró su distribución espacial y temporal. A los 15 minutos de la administración, la rGO se distribuyó por todo el cerebro, y la concentración más alta se localizó principalmente en dos regiones del cerebro, el tálamo y el hipocampo. El análisis cuantitativo de la media de densidades de píxeles (intensidad de iones) como una función de la densidad de RGO y medido en las dos regiones del cerebro reveló un aumento progresivo significativo en el contenido RGO durante los primeros 3 h (Fig. 3F); este aumento indicó un movimiento continuo de rGO desde la sangre periférica al cerebro; 7 días después de la administración de rGO, el contenido de nanomateriales era todavía significativamente mayor que en el control, y un aumento igual en magnitud al observado 15 minutos después de la administración. Esta reducción en el contenido a los 7 días indicó la eliminación de rGO del cerebro.